Sur Terre, le dihydrogène est très abondant sous forme H, atome présent dans l'eau et principal composant du Soleil. (©photo)
Définition et composition
Élément chimique le plus abondant dans l’univers, l’hydrogène (H) est classé en première place du tableau de Mendeleïev. Il s’agit de l’atome le plus simple et le plus léger : il est constitué d’un noyau contenant un proton et d’un électron périphérique.
La molécule H2 de dihydrogène, constituée de deux atomes d’hydrogène, est aussi communément appelée « hydrogène » (nous emploierons cette terminologie dans la fiche). C’est cette molécule H2 qui fait l’objet d’une exploitation chimique et suscite un fort intérêt énergétique, tant par ses possibilités d’usage que de stockage.
Doté d’un seul électron périphérique, H est chimiquement l’atome le plus réducteur et peut se lier à pratiquement tous les éléments, et d’abord à lui-même, pour former la molécule de dihydrogène H2 dont la couche périphérique à deux électrons possède la stabilité du premier niveau d’équilibre quantique. Mais la masse du dihydrogène n’est pas suffisante pour qu’il soit retenu par l’attraction terrestre.
Selon les connaissances actuelles, il est très peu présent sous forme H2 dans la croûte (2/1000 des atomes) comme dans l’atmosphère (0,5 ppm) alors qu’il est l’atome le plus répandu dans l’Univers dont il constitue plus de 90% des atomes et 75% de la masse.
Molécules constituées de l'atome H
L’atome d’hydrogène H est constitué d’un noyau à un seul proton p (chargé positivement e+) et d’un électron périphérique e-.
Sur Terre, l’hydrogène réducteur est présent dans une multitude de molécules dont les plus essentielles à la vie : avec l’oxygène, il forme l’eau (H2O) ; avec le carbone, le méthane (CH4) et la famille des hydrocarbonates constituant la chimie organique ; avec l’azote, l’ammoniac (NH3) et ses dérivés (engrais) ; avec les halogènes, les acides forts (comme l’acide chlorhydrique), etc.
Sous forme H2, c’est principalement un vecteur d’énergie qui doit être produit en l’extrayant de ses composés (eau, méthane, etc.) et qui peut alors réagir puissamment avec les oxydants, en particulier l’oxygène, en dégageant beaucoup d’énergie.
Densité massique vs densité volumique
Comme vecteur d’énergie, le dihydrogène possède trois aptitudes exceptionnelles :
- la plus grande densité massique d'énergie, 1 kg d’hydrogène contient autant d’énergie qu’environ 3 kg de pétrole ;
- une combustion très énergétique dans l’oxygène avec production d’eau pure ;
- une dualité profonde avec l’électricité, avec une capacité de transformation réciproque directe par électrolyse ou pile à combustible.
Ces trois points majeurs font de l’hydrogène, pour certains, l’atout maître de la décarbonation (en complément de l'électrification), en le substituant aux énergies fossiles, pour mettre fin à l’emballement climatique en cours. Il est en particulier vu comme une solution à la gestion de l’intermittence des productions éoliennes et solaires (dont H2 serait le stockeur-déstockeur, permettant ainsi un développement massif de ces filières).
Mais le vecteur d’énergie H2 présente aussi des inconvénients, également majeurs, liés à sa faible densité volumique d'énergie. Pour le stocker, le transporter et le distribuer, il faut soit le liquéfier à pression atmosphérique mais à une température extrêmement basse (- 253 °C), soit le comprimer à très haute pression (700 bars), tout en maîtrisant ses risques de fuite, de corrosion et d’explosion.
Pour pouvoir substituer une économie « hydrogène » à celle de l’« oil and gas » régnante, il faudrait d’abord savoir produire industriellement le nouveau vecteur énergétique « H2 décarboné », sans émission de gaz à effet de serre et à un coût raisonnable.
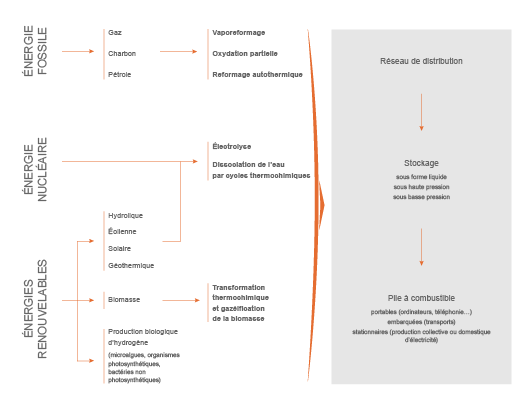
Différents procédés de production
Quand il est produit, l’hydrogène est généré par la séparation d’éléments chimiques dont l’atome H est un composant, et par la mobilisation d’une source d’énergie.
Principaux modes de production de l'hydrogène
Reformage des combustibles fossiles à la vapeur d’eau (ou vaporeformage)
La méthode consiste à casser la molécule de méthane (CH4), principal composant du gaz naturel, qui possède 4 atomes d’hydrogène, avec de la vapeur d’eau à 900°C. Deux réactions successives permettent de produire de l’hydrogène (H2) et du dioxyde de carbone (CO2) :
CH4 + 2 H2O ⇢ 4 H2 + CO2
Ce procédé génère du dioxyde de carbone qui peut être capté et stocké (rarement encore à l'heure actuelle). Notons que le vaporeformage du biogaz est également possible.
Électrolyse de l’eau
Avec cette méthode, le courant électrique décompose la molécule d’eau en hydrogène et en dioxygène (O2) :
H2O + électricité ⇢H2 + ½ O2 + chaleur
Ce procédé correspond à la réaction inverse de celle se produisant dans une pile à combustible.
Cette électrolyse possède différentes variantes, à différentes températures :
- Électrolyse basse température (< 200°C) alcaline utilisant une solution aqueuse d’acide sulfurique (H2SO4) ou d’hydroxyde de potassium (KOH) ;
- Électrolyse basse température (< 200°C) utilisant un électrolyte solide :membrane polymère PEMFC conductrice de protons (Proton Exchange Membrane Fuel Cell) ;
- Électrolyse à haute température (> 400°C) utilisant une membrane céramique conductrice d’ions oxygène (Solid Oxide Fuel Cell), qui doit être couplée à un système solaire à concentration à un réacteur nucléaire à haute température pour profiter d’une source de vapeur bas coût ;
- Gazéification et pyrolyse de biomasse (en particulier de charbon de bois) : procédé en cours de recherche et développement qui permet par exemple d’obtenir de l’hydrogène par transformation chimique du bois à très haute température (entre 1 200°C et 1 500°C). On obtient un mélange de gaz contenant de l’hydrogène (H2) et du monoxyde de carbone (CO). Après purification de ce mélange, on obtient de l’hydrogène.
- Autres procédés à l’état de recherche : d’autres techniques de production d’hydrogène sont actuellement à l’étude comme la photoélectrolyse (cellule photoélectrochimique décomposant l’eau sous l’effet de la lumière), la décomposition thermochimique de l’eau (l’eau est chauffé à 800/1 000°C grâce à l’énergie nucléaire) ou encore des microorganismes (production d’hydrogène par des bactéries modifiées sous l’effet de la lumière du soleil).
La filière hydrogène (©Connaissance des Énergies d'après CEA)
Couleurs de l'hydrogène en fonction de son mode de production
L'hydrogène est souvent associé à différentes couleurs selon son origine, notamment blanc, gris et vert.
- L'hydrogène « blanc » (ou hydrogène naturel) est l'hydrogène naturellement présent dans les gisements souterrains, bien qu'encore rarement exploité directement.
- L'hydrogène « gris » est produit à partir de combustibles fossiles, principalement par reformage du méthane, un processus qui s'accompagne d'importantes émissions de dioxyde de carbone (CO2). Lorsque les émissions de CO2 émis par le procédé sont captés et stockés, l'hydrogène est parfois dit « bleu ».
- L'hydrogène « vert » est produit par électrolyse de l'eau, utilisant de l'électricité issue de sources renouvelables comme l'éolien, le solaire ou l'hydraulique, sans émettre de CO2.
- L'hydrogène « jaune » est produit également par électrolyse mais en utilisant de l'électricité d'origine nucléaire pour alimenter l'électrolyseur.
On appelle généralement « hydrogène bas carbone » l’hydrogène produit par électrolyse grâce à une source d’énergie renouvelable ou nucléaire (voire par vaporeformage de gaz naturel si le procédé est associé à une unité de captage, stockage et valorisation du CO2).
La production d'hydrogène dans le monde
La production industrielle mondiale d’hydrogène gazeux a avoisiné 97 millions de tonnes en 2023, soit une hausse de 2,5% par rapport à 2022 selon les dernières données de l'Agence internationale de l'énergie(1). La Chine compte à elle seule pour environ 30% de la production mondiale.
Cette production était issue à près des deux tiers du gaz naturel (sans captage, stockage et utilisation de CO2) et à environ 20% du charbon ; près de 15% de l'hydrogène mondial étant par ailleurs un coproduit dans les raffineries et l'industrie chimique.

Selon l'AIE, la production mondiale d'hydrogène « bas carbone » en 2023 était encore limitée à moins de 1% de la production mondiale (moins de 1 million de tonnes), « et majoritairement à partir d'énergie fossile, avec captage, stockage et utilisation du CO2».
La production d'hydrogène par électrolyse de l'eau restait inférieure à 100 000 tonnes par an dans le monde en 2023. Près de 75% de cette production est localisée dans 3 zones : la Chine, l'Europe et les États-Unis.
Coûts de production de l'hydrogène
Le vaporeformage du gaz naturel est de loin le principal mode de production et le plus économique (0,8 à 5,7 $ par kg H2 en 2023 selon l'AIE) - mais son prix de revient reste bien plus élevé que celui du gaz naturel.
L'électrolyse de l'eau, qui permet de produire un hydrogène très « propre » si l’électricité est elle-même produite par des sources bas carbone, peut être compétitive d'un point de vue économique si la production d’électricité présente un coût peu élevé.
Ce procédé était il y a peu encore bien plus coûteux que le vaporeformage de combustibles fossiles (3,4 à 12 $ par kg H2 en 2021). Mais ses coûts sont principalement liés au coûts des électrolyseurs et de l'électricité utilisée. Avec la chute des prix notamment dans la filière solaire, l'AIE estime dans son scénario NZE (neutralité carbone) que le coût de production de l'électrolyse (alimentée par des centrales renouvelables) pourrait chuter à près de 2 $ par kg H2 d'ici 2030 dans certaines régions avec un fort ensoleillement (Afrique, Australie, Chine, Moyen-Orient)(2).

Le rendement de cette technique est de 40% sur toute la chaîne, mais peut atteindre 80% en récupérant la chaleur.
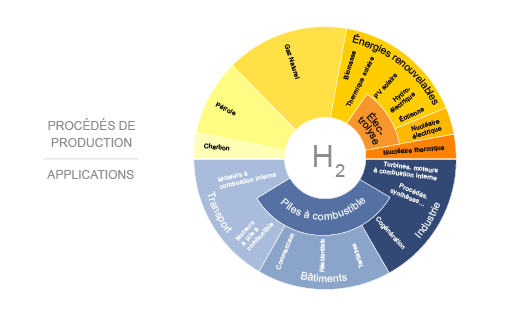
Applications et usages de l'hydrogène
L’hydrogène peut être converti en électricité, en chaleur ou en force motrice selon l’usage final. Il a l’avantage de présenter une capacité de stockage (problématique avec l’électricité) et de pouvoir être produit sans émission de CO2 (même si ce n'est très majoritairement pas le cas aujourd'hui comme indiqué précédemment).
En tant que vecteur énergétique, il trouve ainsi :
- des applications stationnaires : stockage d’énergie dans les bâtiments en assurant une fourniture d’électricité et de chaleur grâce à la cogénération, ce qui permettrait le développement des bâtiments à énergie positive ;
- des applications mobiles : l’hydrogène peut alimenter des véhicules équipés de moteurs à combustion fonctionnant au gaz. Par ailleurs, un réservoir d’hydrogène peut-être associé à une pile combustible pour améliorer l’autonomie de véhicules électriques (électromobilité de 2e génération, dite 2G, la première correspondant aux véhicules électriques) ;
- des applications industrielles : l’hydrogène est un composant chimique très employé dans l’industrie.
La chaîne hydrogène (©Connaissance des Énergies d'après AFH2 – UE)
La plus grande partie de l'hydrogène est utilisée par les industriels pour ses propriétés chimiques, en particulier dans les usines d’ammoniac (60% de l'hydrogène mondial consommé par l'industrie en 2022) et dans les raffineries de pétrole (désulfuration d’essence et de gazole, production de méthanol, etc.).
Voitures à hydrogène
Dans le transport routier, le marché de l'hydrogène « ralentit, l’attention se déplaçant des voitures vers les véhicules utilitaires lourds », indique l'Agence internationale de l'énergie dans son dernier rapport dédié fin 2024.
À fin juin 2024, près de 93 000 véhicules à pile à combustible (tous modes confondus) étaient en circulation dans le monde selon l'AIE.

Notons par ailleurs que l’hydrogène est déjà largement utilisé dans le domaine de l’aérospatial comme combustible pour la propulsion des fusées.
Enjeux énergétiques
L’utilisation de l'hydrogène comme vecteur énergétique, notamment dans le secteur des transports et la production d’électricité, constitue un défi important. Le marché des piles à combustible et le secteur des transports constituent deux perspectives majeures en vue d’une utilisation plus importante de l’hydrogène.
Plusieurs pays se sont en particulier investis ces dernières années dans la recherche appliquée à l’hydrogène : l’Allemagne avec le programme H2 Mobility et Callux, le Japon avec le Japanese Large Scale Fuel Cell Demonstration Programme ou encore les États-Unis avec le US National Hydrogen & Fuel Cell Program.
En France, la filière est mise en valeur auprès des acteurs économiques et du grand public par l’association France Hydrogène (AFH2)(3).
On peut distinguer généralement deux grandes catégories d’acteurs de la filière hydrogène :
- les centres de recherche qui travaillent sur les procédés de production et de transport les plus performants : en France, notamment le CEA, le CNRS ou IFP Énergies nouvelles ;
- les industriels qui travaillent sur les débouchés de ce vecteur énergétique : constructeurs automobiles ou groupes gaziers comme Air Liquide.
Production décarbonée de l’hydrogène
L’intérêt de l’hydrogène dans la lutte contre les émissions de gaz à effet de serre dépend évidemment de la manière dont il est produit. Une chaîne non carbonée de production existe (électrolyse ou séquestration de CO2, s’il est issu des énergies fossiles).
La conjonction de trois facteurs conditionne le développement d’une filière énergétique de l’hydrogène : compétitivité en termes de prix, rendement énergétique et absence d’émission de CO2.
En 2023, la France a doublé sa capacité de production d'hydrogène bas carbone et est capable de produire 12 tonnes d'hydrogène décarboné par jour, avec une capacité d'électrolyse installée de 30 mégawatts (MW), contre seulement 13 MW début 2023. Mais elle reste très éloignée de son objectif affiché pour 2030 : 6,5 gigawatts de capacité de production installée, et 10 GW en 203. la France est sur le podium des trois premiers pays en Europe" derrière la Suède (1.400 MW de capacité sécurisée) et Allemagne (550 MW).
Gestion des intermittences des énergies renouvelables
Avec les piles à combustible, l’hydrogène énergie permet de stocker et de produire de l’électricité à la demande, valorisant ainsi les énergies renouvelables intermittentes.
Stockage et transport de l’hydrogène
L’hydrogène est difficile à stocker et à transporter, en raison de sa faible densité énergétique par unité de volume. Le transport s’effectue généralement en bouteilles ou en pipelines sous forme comprimée : le gaz peut être comprimé de quelques dizaines de bars à 350 ou 700 bars pour être acheminé. D’autre part, il est possible de le liquéfier l’hydrogène à –253°C mais cette transformation est très énergivore. Notons également la possibilité de transporter l’hydrogène sous forme d’hydrure métallique (la réaction d’hydruration est en effet réversible).
Le réseau de gaz naturel peut aussi contenir de l’hydrogène jusqu’à 20% en volume mais cela nécessite de le purifier en aval du réseau. Notons qu’il faut dix fois plus d’espace pour stocker de l’hydrogène gazeux par rapport à l’essence.
Utilisation dans les transports
Le secteur des transports offre un potentiel de développement majeur au vecteur hydrogène : celui-ci peut être utilisé directement dans des moteurs à combustion interne ou dans des piles à combustible.
Des moteurs à combustion utilisant l’hydrogène équipent déjà des bus et des bennes à ordures ménagères sous forme d’hythane (mélange 20% hydrogène / 80% gaz naturel).
Aujourd’hui, avec 1 kg d’hydrogène, une voiture peut parcourir près de 100 km.
Sécurité
La réputation de l’hydrogène pâtit de quelques accidents historiques comme l’incendie du dirigeable Hindenburg en 1937 ou l’explosion de la navette Challenger le 28 janvier 1986.
Néanmoins, ce gaz se révèle moins dangereux que le gaz naturel. Dans les voitures fonctionnant à hydrogène, on rajoute un colorant au gaz. En cas de fuite, l’hydrogène est invisible, inodore et n’est chaud qu’au-dessus de la source.
Étant très léger, le gaz se libère verticalement, ce qui constitue un avantage en termes de sécurité.
Avantages et inconvénients
L’hydrogène peut être converti en électricité, en chaleur ou en force motrice et a ainsi de nombreuses applications possibles. L’hydrogène est cependant difficile à stocker et à transporter en raison de sa faible densité énergétique par unité de volume.
L’hydrogène énergie est prometteur à plus d’un titre. Néanmoins, son exploitation à l’échelle industrielle en est à ses balbutiements.
Un fort potentiel à plusieurs niveaux
Vecteur énergétique d’avenir et substitut possible aux hydrocarbures, elle présente plusieurs avantages conséquents :
- sa combustion génère une forte quantité d’énergie (environ 3 fois plus que l’essence à poids constant) ;
- elle est très abondante sur Terre sous forme atomique (eau, hydrocarbures, etc.). Le dihydrogène existe aussi à l'état naturel (les premières sources naturelles d’hydrogène ont été découvertes au fond des mers dans les années 1970 et plus récemment à terre) ;
- sa combustion peut être non carbonée (pas d’émission de CO2 lorsqu’il est issu de sources renouvelables) ;
- elle est stockable et peut constituer un moyen efficace de stockage de l’électricité sur des durées longues.
La combustion de l'hydrogène génère environ 3 fois plus d'énergie que l’essence à poids constant.
Une technologie pas encore aboutie
Cependant, l’hydrogène énergie (ou vecteur hydrogène) se heurte encore à plusieurs limites :
- le stockage de l’hydrogène nécessite des quantités d’énergie importantes en raison de sa faible densité (il peut être stocké sous forme comprimée, liquide ou encore d’hydrure métallique) ;
- l’efficacité de son transport (énergie transportée par unité de volume) est beaucoup moins forte que celle du pétrole ou du gaz en raison de cette faible densité ;
- des risques d’inflammabilité et de détonation avec l’air existent (bien que moindres que pour le gaz naturel) ;
- le coût du procédé de production d’hydrogène le plus prometteur, l’électrolyse de l’eau, reste élevé bien qu'en forte baisse ;
- son utilisation grand public dans les transports nécessite la mise en place d’un réseau de stations à hydrogène (de type stations services) qui requiert des investissements considérables, alors que l'accent est actuellement porté sur l'électromobilité et les infrastructures associées.
Histoire : les grandes dates de l'hydrogène
- 1671 : Première intuition : Robert Boyle rapporte que les vapeurs dégagées par la dissolution de fer dans l’acide chlorhydrique sont hautement inflammables.
- 1766 : Découverte de l’hydrogène par Henry Cavendish qui isole le gaz.
- 1781 : Démonstration par Cavendish de la formation d’eau lorsque l’hydrogène brûle. Le chimiste français Antoine Lavoisier appelle le gaz hydrogène.
- 1839 : Découverte de la pile à hydrogène.
- 1898 : Première liquéfaction de l’hydrogène obtenue par l’anglais Sir James Dewar.
- 1929 : Premier vol d’un dirigeable à hydrogène, le LZ 127 Graf Zeppelin, marquant une étape importante dans l'utilisation de l'hydrogène pour l'aviation.
- 1937 : Catastrophe du Hindenburg, un dirigeable à hydrogène, qui prend feu lors de son arrivée à Lakehurst, New Jersey, marquant un coup d'arrêt aux dirigeables à hydrogène pour le transport de passagers.
- 1960 : Début de l'utilisation de l'hydrogène dans les piles à combustible pour les missions spatiales de la NASA, notamment le programme Apollo, fournissant électricité et eau aux astronautes.
- 1970 : Invention du terme « économie hydrogène » par l'économiste John Bockris, envisageant l'hydrogène comme un vecteur énergétique central pour l'avenir.
- 2003 : Lancement de l'Initiative hydrogène par le président américain George W. Bush, visant à accélérer le développement des technologies de l'hydrogène et des piles à combustible.
- 2015 : Mise en circulation de la Toyota Mirai, l'une des premières voitures à hydrogène produites en série, marquant une avancée significative pour l'hydrogène dans les transports.
- 2020 : Publication de la stratégie européenne pour l'hydrogène, avec des objectifs ambitieux pour la production d'hydrogène vert et le développement des infrastructures correspondantes, consolidant l'hydrogène comme un élément clé de la transition énergétique en Europe.
- 2023 : Publication en France par le gouvernement de la nouvelle stratégie nationale pour le déploiement de l'hydrogène décarboné(4). La stratégie fixe notamment comme objectif d'installer « une capacité de production électrolytique d’hydrogène bas carbone de 6,5 GW en 2030 et de 10 GW en 2035 ».