Pile à combustible pour automobile développée en 2006 par le CEA (©P. Stroppa/CEA)
Définition
Une pile à combustible permet de convertir directement de l’énergie chimique de combustion en énergie électrique, en chaleur et en eau. Cela passe par une réaction chimique produisant un transfert d'électrons, qu'on appelle oxydo-réduction.
La pile à combustible est parfois dénommée par son sigle PAC.
Cœur de pile
Le cœur pile à combustible d’une est constitué de trois éléments, dont deux électrodes : une anode oxydante (émettrice d’électrons); une cathode réductrice (collectrice d’électrons) séparées par un électrolyte.
L’électrolyte a la propriété de conduire directement d’une électrode à l’autre des molécules ionisées et de faire barrage aux électrons en les obligeant à passer par le circuit extérieur de la pile ou leur énergie électromotrice peut être exploitée.
Combustible
L’alimentation d’une PAC se fait par injection continue de combustible à l’anode, généralement de l’hydrogène, et à la cathode, généralement le dioxygène (oxygène dans le langage courant) de l’air ou l’air lui-même. Une énergie électrique continue est alors disponible aux bornes de la pile.
Dans le langage courant, les piles à combustible utilisant généralement l’hydrogène ou un combustible hydrogéné sont appelées « piles à hydrogène ».
Les piles à combustible se différencient d’abord par la nature de leur électrolyte, soit acide conduisant les ions positifs (protons H+) de l’anode à la cathode, soit basique (anions OH-, O2-, CO32-) en sens contraire.
Types
On distingue ainsi 6 types de piles à combustible :
- Trois à électrolytes acides (ions H+ migrant de l’anode vers la cathode) :
- les PEMFC (Proton Exchange Membrane Fuel Cell). L’électrolyte est constitué d’une membrane solide polymère fonctionnant à basse température. (20-100°C). Celle-ci transmet sélectivement vers la cathode les ions H+ formés par oxydation catalytique de l’hydrogène injectée directement sur l’anode ;
- les DMFC(Direct Methanol Fuel Cell). Au lieu d’hydrogène, ces piles utilisent comme combustible le méthanol (CH3OH). Injecté directement sur l’anode avec de l’eau son oxydation catalytique produit des ions H+ et du gaz carbonique. Comme sur les PEMFC, une membrane solide polymère transmet sélectivement les H+ vers la cathode ;
- les PAFC(Phosphorique Acid Fuel Cell) utilisent à la place de membranes solides de l’acide phosphorique liquide occlus dans une matrice solide poreuse. Elles peuvent fonctionner jusqu’à 200°C.
- Trois à électrolytes basiques (ions négatifs migrant de la cathode vers l’anode) :
- les AFC à potasse liquide (Alkaline Fuel Cell) utilisent l’ion OH- libéré par réduction catalytique de cette base sur la cathode ;
- les MCFC (Molten Carbonate Fuel Cell) utilisent des carbonates de lithium et de potassium fondus pour faire migrer des ions CO32- ;
- les SOFC (Solid Oxyde Fuel Cell) exploitent un électrolyte solide (zircone dopé aux terres rares) pour produire des ions O2-.
Applications concrètes
Les piles à combustible se différencient aussi par leurs domaines d’application.
Ce sont principalement :
- les transports : voitures électriques, bus, aéronefs ;
- les appareils portables : ordinateurs, téléphones, DVD, etc ;
- la production stationnaire d’électricité et la cogénération chaleur/électricité ;
- la Défense (sous-marins) et l’espace.
Chaque domaine d’application exige des puissances électriques, des températures de fonctionnement, des modes d’alimentation en combustibles (hydrogène, méthanol, oxygène…) correspondant à un type de pile.
Les familles PEMFC, DMFC et AFC fonctionnent à basse température (20-100°C) et ont des puissances allant de quelques watts à la centaine de kilowatts. Elles conviennent donc plutôt aux applications portables et aux transports.
Les piles à acide phosphorique (PAFC) fonctionnent à moyenne température (200°C) dans une gamme de puissance 50-200 kW. Modulaires, elles peuvent être assemblées en générateurs stationnaires de 10 MW (Toshiba, Fuji) pour des emplois de secours et d’appoint.
Les piles fonctionnant à haute température, MCFC (650°C) et SOFC (800-1000°C) ont des rendements électriques élevés. Elles sont adaptées à la production massive d’électricité et à sa cogénération avec la chaleur pour l’industrie et l’habitat. Les puissances fournies sont de l’ordre de 100 MW. Les SOFC peuvent être alimentées avec de nombreux combustibles.
Les filières PEMFC et SOFC se distinguent par l’étendue des applications qu’elles peuvent couvrir. Elles font l’objet des efforts de R&D les plus intenses.
Fonctionnement et réactions électrochimiques
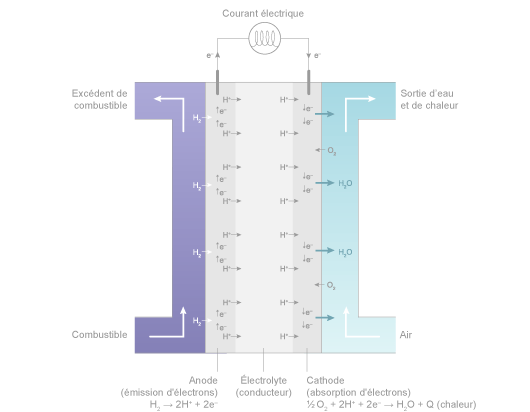
Dans le cœur d’une pile à hydrogène du type PEMFC à membrane solide acide, deux réactions électrochimiques se produisent successivement :
- à l’anode : oxydation catalytique, en présence de platine, de l’hydrogène qui se dissocie de ses électrons :
H2 → 2H+ + 2e- - à la cathode : réduction catalytique, en présence de platine, de l’oxygène qui capture les ions H+ qui ont traversé la membrane électrolyte et les électrons arrivant du circuit extérieur. La réaction produit de la chaleur et de l’eau :
½ O2 + 2H+ + 2 e- → H2O + Q (chaleur)
Schéma de fonctionnement d’une pile PEMFC (acide) ©Connaissance des Énergies
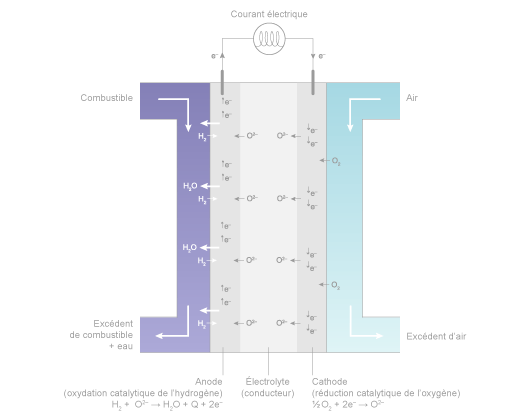
Dans le cœur d’une pile à électrolyte basique comme les SOFC, ces réactions deviennent :
- à la cathode : réduction catalytique de l’oxygène :
½ O2 + 2 e- → O2- - à l’anode : oxydation catalytique de l’hydrogène qui capture les ions O2- qui ont traversé l’électrolyte pour donner de la chaleur et de l’eau :
H2+O2-→ H2O + Q (chaleur) + 2e-
Schéma de fonctionnement d’une pile SOFC (basique) ©Connaissance des Énergies
Dans les deux cas, les électrons sont libérés sur l’anode puis, bloqués par l’électrolyte, passent par le circuit extérieur de la pile et fournissent de l’énergie électrique (force électromotrice) avant de se recombiner sur la cathode avec l’oxygène.
Le rôle du catalyseur dans l’oxydation de l’hydrogène à l’anode et de la réduction de l’oxygène à la cathode est essentiel dans le rendement de la pile.
On utilise encore aujourd’hui principalement le platine, qui est déposé en couches minces sur la surface des deux électrodes, mais en plus grande quantité sur la cathode, la réaction de réduction y étant plus difficile à catalyser. Or le platine est un métal rare, très coûteux, qui pèse lourdement sur la compétitivité des piles à combustible actuelles. Des nanomatériaux catalytiques sont activement étudiés pour surmonter cet obstacle majeur.
Usages actuels et à venir
Transports
Développées dès 1950 pour les programmes spatiaux de la NASA et les sous-marins classiques, les piles alcalines AFC ont été ensuite développées en série pour des véhicules spéciaux (taxis, golf, nettoyage urbain, etc.).
Quelques entreprises les commercialisent (Zeste Power Corp., Astis Inc, Apollo Energy Systems, etc.). Ces piles restent coûteuses et difficiles à entretenir.
Toutes les autres familles de piles sont encore au stade des laboratoires, des prototypes et des démonstrateurs. L’effort principal porte aujourd’hui sur les PEMFC et les SOFC.
Les PEMFC sont activement étudiées pour les véhicules électriques et pour les applications liées à l’électronique nomade. Les principaux acteurs sont les constructeurs automobiles : General Motors, Mercedes, Nissan et Toyota, Renault et Stellantis mènent des recherches à la fois intenses et secrètes, à la mesure de l’enjeu. Stellantis est engagé depuis 2006 dans un partenariat avec le CEA pour développer GENEPAC, pile PEMFC de 80 kW, en cours d’intégration sur un ZEV expérimental (Zéro Emission Véhicule). On peut également citer la société BIC qui développe un système innovant sur des PEMFC de très faible puissance (<100 W).
De manière plus marginale, l’équipementier automobile Delphi s’intéresse à cette technologie pour le secteur automobile afin d’alimenter des auxiliaires de bord en complément d’une pile de type PEMFC.
Des véhicules équipés de piles à hydrogène sont actuellement en circulation, mais il ne s’agit que de quelques centaines de véhicules destinées à fournir un retour d’expérience aux constructeurs automobiles. La date de commercialisation estimée varie selon les acteurs.
Bien entendu, le développement des piles à combustible pour l’automobile ne pourra se faire sans une filière hydrogène, c'est-à-dire sans le développement de systèmes de stockage et de distribution fiable de ce gaz très léger, fuyant et explosif.
Production d'électricité et de chaleur
La principale application des piles de type SOFC est la cogénération d’électricité et de chaleur. Les principaux acteurs intéressés par ce type de pile sont donc des industriels de ce domaine. On peut citer UTC Fuel Cella, Siemens-Westinghouse, Rolls-Royce.
Recherche et entreprises spécialisées
Par ailleurs, il existe des entreprises spécialisées dans les piles à hydrogène. On peut par exemple citer Ballard (Canada), ou Axène (filiale d’Air Liquide) et Hélion (filiale d’Areva-TA) en France.
Il existe également de nombreuses entreprises fabriquant des matériaux de piles de type PEMFC. Les États-Unis sont leaders avec 3M (électrodes) et Dupont de Nemours qui fournit actuellement le Nafion, meilleure membrane sur le marché.
Mis à part ces acteurs industriels, de nombreux organismes de recherche étudient les PAC grâce au soutien de financements publics en Europe (Union européenne), au Japon (NEDO, New Energie and Industrial Technology Développement Organisation), aux États-Unis (DOE, Département Of Energy). En France, le CEA est particulièrement actif pour introduire les nanotechnologies dans le cœur des PAC.
Enjeux, potentiel et limites
Depuis plusieurs décennies, les piles à combustibles sont régulièrement présentées comme la solution pour produire de l’énergie électrique.
De gros atouts
Rendements élevés, silencieuses, modulaires, sans pièce mobile, couvrant une large étendue de températures et d’applications : les PAC ont de sérieux avantages auxquels s’ajoute la protection de l’environnement puisqu’elles ne produisent que de la chaleur et de l’eau.
L'hydrogène, pas encore vert
Mais c’est oublier qu’aujourd’hui l’hydrogène, combustible des PAC, est produit à 95% à partir du reformage de combustibles fossiles avec émission massive de CO2. C’est donc dans la production « propre ou décarbonée » d’hydrogène que réside un élément exogène majeur conditionnant un développement massif des PAC.
Coût élevé
Au-delà, il restera l’obstacle endogène essentiel, le coût des technologies des piles à combustibles actuelles. Les membranes (par exemple la pile Nafion de DuPont de Nemours) incorporent des composants fluorés relativement onéreux. Il en est de même du platine, sur les électrodes. En définitive, des progrès très importants dans la maîtrise des coûts des matériaux des cœurs de piles sont indispensables pour que les PAC constituent enfin une solution compétitive pour produire de l’électricité courante.
Pour espérer une commercialisation massive, le coût, le rendement et la compacité des PAC doivent encore être nettement améliorés. Or les matériaux actuellement utilisés s’usent trop rapidement par rapport à la durée d’utilisation prévue pour les piles à hydrogène (plusieurs milliers d’heures) et le coût du platine catalyseur est prohibitif. Alors que l’automobile exigerait des coûts inférieurs à 50 €/kW, le platine ne permet pas de descendre en dessous de plusieurs milliers d’euros/kW, la puissance moyenne visée pour un véhicule électrique étant de 80 kW.
Une technologie pas encore aboutie
Actuellement, la pile à hydrogène de type SOFC est prometteuse, mais nécessite encore des développements. La température de fonctionnement de ce type de pile doit notamment être abaissée.
La pile à hydrogène de type PEMFC semble la plus proche d’un débouché sur un marché de masse (électronique et transports notamment). Toutefois, la plupart des piles de ce type sont encore au stade de démonstrateurs.
Histoire et développement
1838 : C.F. Schönbein découvre le principe de la pile à combustible : il réalise l’électrolyse de l’eau (grâce à un courant électrique il obtient de l’hydrogène et de l’oxygène) mais s’aperçoit qu’en coupant le courant, ces gaz donnaient lieu à un courant électrique inverse au premier.
1839 : W.R. Grove réalise la première pile à hydrogène en laboratoire.
1939-1953 : les travaux de Francis T. Bacon permettent la mise en place d’un premier prototype industriel de puissance (de l’ordre du kW).
1960 : la NASA sort la pile à hydrogène de l’oubli en l’utilisant pour alimenter ses véhicules spatiaux.
1973 : suite au premier choc pétrolier, il apparait indispensable d’être énergétiquement indépendant. Les recherches sur les piles à combustible reprennent de manière plus importante aux Etats-Unis, au Japon et en Europe grâce à cette prise de conscience.
Années 1980 : en raison des coûts rédhibitoires des catalyseurs et des membranes, l’élan des recherches sur les PAC est freiné.
Années 1990 : l’aggravation des problèmes environnementaux (notamment le réchauffement climatique et la pollution atmosphérique) ainsi que les avancées technologiques entraînent un regain d’intérêt pour ces systèmes.
Années 2000 : les piles à combustible commencent à être utilisées dans des applications commerciales, notamment dans les véhicules et les systèmes de cogénération domestique, grâce à la réduction des coûts et à l'amélioration de l'efficacité des technologies associées.
Années 2010 : les avancées dans les matériaux et la fabrication, ainsi que les préoccupations croissantes concernant les émissions de carbone, stimulent la recherche et le développement des piles à combustible, avec des initiatives de soutien de la part des gouvernements et des entreprises privées.
Années 2020 : les piles à combustible se positionnent comme une solution clé pour la transition énergétique, avec des applications croissantes dans les transports, l'industrie et les infrastructures énergétiques, et une attention accrue à l'hydrogène vert produit à partir de sources renouvelables.